El mundo de la estereoquímica
La estereoquímica es una parte de la química que toma como base el estudio de la distribución espacial de los átomos que componen las moléculas y el como afecta esto a las propiedades y re-actividad de dichas moléculas. También se puede definir como el estudio de los isómeros: compuestos químicos con la misma fórmula molecular pero de diferentes fórmulas estructurales.
La isomería es una propiedad de ciertos compuestos químicos que con igual fórmula química, es decir, iguales proporciones relativas de los átomos que conforman su molécula, presentan estructuras moleculares distintas y, por ello, diferentes propiedades. Dichos compuestos reciben la denominación de isómeros. Los isómeros son compuestos que tienen la misma fórmula molecular pero diferente fórmula estructural y, por tanto, diferentes propiedades. Por ejemplo, el alcohol etílico o etanol y el éter dimetílico son isómeros cuya fórmula molecular es C2H6O.
Aunque este fenómeno es muy frecuente en Química orgánica, no es exclusiva de ésta pues también la presentan algunos compuestos inorgánicos, como los compuestos de los metales de transición.
Se divide en :
Isomeros estructurales :
Isómeros de cadena: Se distinguen por la diferente
estructura de las cadenas carbonadas. Un ejemplo de este tipo de isómeros son
el butano y el 2-metilpropano
. Isómeros de posición : El grupo funcional ocupa una
posición diferente en cada isómero. El 2-pentanol y el 3-pentanol son isómeros
de posición.
Isómeros de función:
El grupo funcional es diferente. El 2-butanol y el dietil éter presentan la misma
fórmula molecular, pero pertenecen a familias diferentes -alcohol y éter- por
ello se clasifican como isómeros de función.
Estereoisomeros:
configuracionales: No pueden interconvertirse a temperatura
ambiente. Por ello, a diferencia de los isomeros conformacionales , pueden separarse.
Para pasar de uno a otro es preciso normalmente romper y formar enlaces.
Hay dos clases:
Geométricos: Los que
se originan por la distinta orientación de átomos o grupos respecto de un doble
enlace o un plano de anillo.
Ópticos: Los que se
originan por la distinta orientación espacial en torno a un estereocentro . Se
les denomina así por su distinto comportamiento frente a la luz polarizada.
Esta clase abarca a dos tipos de isómeros configuracionales
Los enantiómeros: que
se relacionan por ser imágenes especulares no superponible Los
diastereoisómeros o diastereómeros: isómeros configuracionales que no son
imágenes especulares uno del otro.
Ejemplo isomeros geometricos :
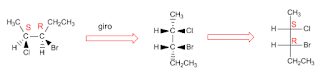
Ejemplo isomeros opticos :2-bromobutano.
hay dos isomeros opticos, son imagenes especulares y no son superponibles.
diagrama de energía vs coordenada de reacción, las dos etapas de propagación para la halogenación del metano.
Diagrama de energía :
La primera etapa de propagación es la que limita la velocidad del proceso, tiene la mayor energía de activación. El el diagrama se representan reactivos, productos, intermedios y estados de transición para la halogenación radicalaria del metano.
En el primer estado de transición se forma el enlace H-Cl y se rompe el C-H. En el segundo estado de transición se forma el enlace C-Cl y rompe el Cl-Cl.
Mecanismo de la SN2
Mecanismo de la SN2
Diagrama de energía:
La reacción SN2 transcurre en un sólo paso (reacción elemental) y su diagrama de energía consta de un único estado de transición en el que unos enlaces están medio rotos y otros medio formados.
El etano es el alcano más sencillo que puede existir en diferentes conformaciones. De las infinitas conformaciones que se pueden obtener por giro del enlace carbono-carbono, destacan por su importancia las conformaciones alternada y eclipsada.
Diagrama de enegía potencial Un diagrama de energía potencial nos permite entender como cambia la energía potencial del sistema durante la rotación. En estos diagramas se representa la energía potencial de la molécula frente al ángulo girado. Para el etano tiene la siguiente forma:
Cis-trans:
La isomería cis-trans o geométrica es debida a la rotación restringida entorno a un enlace carbono-carbono. Esta restricción puede ser debida a la presencia de dobles enlaces o ciclos. Así, el 2-buteno puede existir en forma de dos isómeros, llamados cis y trans. El isómero que tiene los hidrógenos al mismo lado se llama cis, y el que los tiene a lados opuestos trans.
Los compuestos cíclicos, debido a su rigidez, también presentan isomería geométrica. Así, el 1,2-dimetilciclohexano puede existir en forma de dos isómeros. Se llama isómero cis el que tiene los hidrógenos al mismo lado y trans el que los tiene a lados opuestos.
Notacion Z/E
El sistema de nomenclatura cis/trans en alquenos es insuficiente cuando hay tres o más sustituyentes diferentes en el doble enlace. En estos casos se usa el sistema de nomenclatura Z/E, adoptado por la IUPAC, que sirve para todos los alquenos. Z proviene del vocablo alemán zusammen que significa juntos y E del vocablo alemán entgegen que significa opuesto. Equivaldrían a los términos cis y trans respectivamente. Si una configuración molecular es Z o E viene determinado por las reglas de prioridad de Cahn, Ingold y Prelog. Para cada uno de los dos átomos de carbono del doble enlace se determina individualmente cual de los dos sustituyentes tiene la prioridad más alta. Si ambos sustituyentes de mayor prioridad están en el mismo lado, la disposición es Z. En cambio si están en lados opuestos la disposición es E. Como ejemplo, en la imagen el ácido (Z)-3-amino-2-butenoico y el ácido (E)-3-amino-2-butenoico.
En la proyección de Fischer la molécula se dibuja en forma de cruz con los sustituyentes que van al fondo del plano en la vertical y los grupos que salen hacia nosotros en la horizontal, el punto intersección de ambas líneas representa el carbono proyectado.
Aunque se acostumbra a dejar la cadena carbonada en la vertical, puede girarse la molécula de diferentes formas dando lugar a proyecciones de Fischer aparentemente diferentes, pero que en realidad representan la misma molécula. Para comprobar que la proyección está bien hecha, vamos a dar notación R/S a la molécula y a su proyección.
Ahora haremos la proyección de una molécula con dos centros quirales
¿Cómo hacer una proyección de Fischer?
Proyectar consiste en dibujar en dos dimensiones (plano) una molécula. En la proyección de Fischer la molécula se dibuja en forma de cruz con los sustituyentes con los sustituyentes que van al fondo del plano en la vertical y los grupos que salen hacia nosotros en la horizontal, el punto intersección de ambas líneas representa el carbono proyectado.
Proyección de Fischer del 2-Clorobutano
La proyección de Fischer puede hacerse para varios carbonos de la molécula. El primer paso consiste en dibujar la molécula eclipsada y en segundo lugar girarla dejando unos grupos hacia nosotros y otros al fondo del papel.
Proyección de Fischer del 2-Bromo-3-clorobutano
Proyeccion de newnam:
La proyección de Newman se obtiene al mirar la molécula a lo largo del eje C-C. El carbono frontal se representa por un punto, del que parten los tres enlaces que lo unen a los sustituyentes. El carbono de atrás se representa por un círculo y los enlaces que salen de este carbono se dibujan a partir de este círculo.
Proyección de Newman para las conformaciones del butano:
En la columna derecha se incluyen las conformaciones sin, anti y gauche del butano, con sus respectivas proyecciones de Newman, en las que se pueden observar las interacciones entre grupos metilo. La conformación más estable es la anti (no presenta repulsiones metilo-metilo), siendo la conformación sin la de mayor inestabilidad (energía elevada) debido al eclipsamiento metilo-metilo.
proyección de Newman del etano alternado: Miramos la molécula situándonos en la posición de la flecha. Representamos el carbono que tenemos enfrente por un punto y sacamos los enlaces que parten hacia los hidrógenos. El carbono que está al fondo no podemos verlo, aunque si vemos los hidrógenos que parten de él (representados en rojo). Lo representamos por un círculo y sacamos los enlaces que lo unen a los hidrógenos (representados en azul)
Al proyectar la conformación del etano que tiene todos los hidrógenos enfrentados (llamada conformación eclipsada). Situándonos en la posición de la flecha tenemos enfrente el carbono con los hidrógenos rojos. Los hidrógenos azules quedan tapados y no podemos verlos. En la proyección de Newman estos hidrógenos (azules) aparecen ligeramente girados para poder representarlos.
Bibliografia :
http://www.quimicaorganica.org/estereoquimica.html
http://www.profesorenlinea.cl/Quimica/Estereoquimica_e_isomeria.html
http://www.uv.es/~gblay/TEMA%202
http://quimicaisomeros.galeon.com/pagina_nueva_2.htm
https://www.quimicayalgomas.com/quimica-organica/tipos-de-isomeria/
http://www.quimicaorganica.net/radicalarias-diagrama-energia.html
http://docencia.udea.edu.co/cen/QuimicaOrganicaIII/paginas/criterio_c/08sesion/diagramas.html
http://www.quimicaorganica.org/reacciones-sustitucion-sn2/380-diagrama-de-energia-en-la-sn2.html
http://www.quimicaorganica.org/estereoquimica/538-proyeccion-de-fischer.html
http://www.quimicaorganica.org/alcanos/67-proyeccion-de-newman.html
http://www.liceoagb.es/quimiorg/newman.html



























entendí perfectamente.le doy un 5 de 5
ResponderEliminarmuy interesante ,entendí
ResponderEliminarMuy completo el contenido, me sirvió demasiado, gracias.
ResponderEliminarEstos son el tipo de blogs que te hacen amar la química, la imágenes muy claras, me fue de gran utilidad. gracias.
ResponderEliminarmuy preciso y necesario el contenido buen trabajo
ResponderEliminarme salvas la vida
ResponderEliminarGracias , tiene un contenido muy completo fue en el unico blog que encontro buenos ejemplos con imagenes que se explican por si solas .
ResponderEliminarGracias , tiene un contenido muy completo fue en el unico blog que encontro buenos ejemplos con imagenes que se explican por si solas .
ResponderEliminarGracias por el post está muy completo y me fue de gran ayuda, genial las imagenes
ResponderEliminarMe encantó, excelente información y muy buena la explicación además las imagenes son muy claras, me fue muy útil. Mil gracias.
ResponderEliminarEstereoquimica me ha dado muy duro mil gracias por esa explicación del tema, me ayudó un montón
ResponderEliminarEstereoquimica me ha dado muy duro mil gracias por esa explicación del tema, me ayudó un montón
ResponderEliminarey buen pots esto va sevir para ganar todos lo parciales
ResponderEliminarBuen contenido, fácil de entender
ResponderEliminarSirve mucho para aclarar dudas del tema